Les méthodes de caractérisation de performance précises sont cruciales dans l’étude des performances des électrocatalyseurs. Cet article détaillera plusieurs méthodes courantes de test de performance des électrocatalyseurs, y compris les tests de batterie unique, l’électrode à disque rotatif (RDE) et l’électrode à disque-anneau rotatif (RRDE), la voltampérométrie cyclique (CV), et la voltampérométrie à balayage linéaire (LSV). Chaque méthode a ses avantages uniques et son champ d’application. Comprendre les principes de base et les scénarios d’application de ces méthodes aidera à évaluer de manière plus complète et précise les performances des électrocatalyseurs, faisant ainsi avancer la recherche sur les piles à combustible et d’autres applications électrochimiques.
Batterie unique
Une méthode importante pour caractériser les performances des électrocatalyseurs consiste à mélanger l’électrocatalyseur, l’alcool, l’eau et une résine conductrice de protons dans un certain ratio pour former une boue. Cette boue est ensuite pulvérisée ou brossée sur une membrane d’échange de protons ou une couche de diffusion de gaz, et une électrode à membrane est obtenue par pressage à chaud. La performance catalytique est évaluée en utilisant la méthode de la batterie unique, qui permet de comparer différents électrocatalyseurs.
Cette méthode est très efficace, en particulier dans le domaine de la recherche sur les piles à combustible, car elle peut évaluer les performances électrochimiques des catalyseurs dans des conditions de travail réelles et prendre en compte des facteurs tels que la distribution du catalyseur dans l’électrode à membrane, la conductivité protonique et la diffusion des gaz. Cependant, les conditions de préparation de l’électrode à membrane impactent significativement l’évaluation des performances des électrocatalyseurs. La méthode de la batterie unique mesure la performance globale de l’électrocatalyseur mais ne permet pas de rechercher en profondeur les mécanismes de réaction catalytique sur la surface de l’électrocatalyseur.
Méthodes de l’électrode à disque rotatif et de l’électrode à disque-anneau rotatif
L’électrode à disque rotatif (RDE) et l’électrode à disque-anneau rotatif (RRDE) sont deux méthodes de test électrochimiques couramment utilisées pour évaluer les performances des électrocatalyseurs. Ces méthodes peuvent rapidement évaluer la performance électrochimique initiale des électrocatalyseurs, telle que l’activité, la stabilité et les mécanismes de réaction, en un temps relativement court. Elles sont particulièrement adaptées à l’étude des mécanismes des réactions électrochimiques, telles que la réaction de réduction de l’oxygène (ORR). En contrôlant la vitesse de rotation, ces méthodes peuvent contrôler précisément le processus de transfert de masse, fournissant des conditions de test stables et hautement reproductibles.
Électrode à disque-anneau rotatif (RRDE) : il s’agit d’une technique de mesure électrochimique développée à partir de la RDE et particulièrement adaptée à la détection des produits intermédiaires dans les réactions électrochimiques. Si une réaction de réduction se produit sur l’électrode à disque, les produits intermédiaires générés seront transportés par le flux de solution vers l’électrode annulaire. En appliquant un potentiel à l’électrode annulaire qui peut oxyder les produits intermédiaires, le courant de réaction d’oxydation peut être détecté sur l’électrode annulaire, permettant ainsi d’étudier plus avant la voie de réaction et la formation et la consommation des produits intermédiaires.
Comparé aux méthodes de batterie unique, la RDE et la RRDE sont plus adaptées à l’évaluation préliminaire de la performance et aux études des mécanismes de réaction, tandis que la méthode de batterie unique fournit une évaluation plus complète de la performance globale du catalyseur dans des conditions de travail réelles. Pour les tests ORR, le taux de production de H2O2 et le nombre de transferts d’électrons (n) lors du processus de réduction de l’oxygène sur l’électrocatalyseur peuvent être calculés en utilisant la formule suivante :
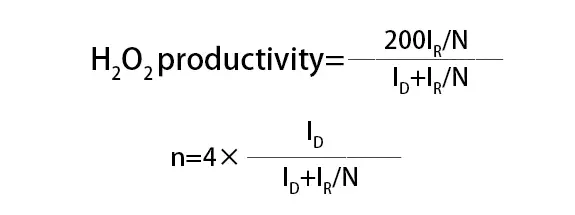
où ID est le courant faradique sur l’électrode à disque, IR est le courant faradique sur l’électrode annulaire, et N est l’efficacité de collecte de l’électrode à disque pour le H2O2.
Voltamétrie cyclique (CV)
La voltamétrie cyclique (CV) est une méthode expérimentale transitoire électrochimique couramment utilisée pour étudier la cinétique et les mécanismes de réaction. En contrôlant le potentiel de l’électrode pour balayer sous une forme d’onde triangulaire à différentes vitesses au fil du temps, des réactions d’oxydation et de réduction alternées se produisent sur l’électrode, et la courbe courant-potentiel, connue sous le nom de voltammogramme cyclique, est enregistrée.
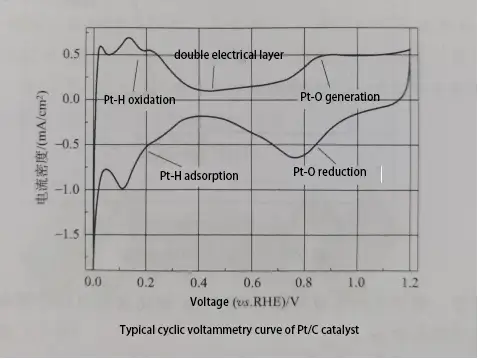
La figure montre une courbe CV typique pour un catalyseur Pt/C, divisée en cinq parties : pic d’adsorption de l’hydrogène, région de double couche, pic d’oxydation de surface du Pt, pic de réduction de l’oxyde de Pt et pic de désorption de l’hydrogène. À partir de la courbe de désorption de l’hydrogène sur l’électrode de Pt dans la courbe CV, la surface active électrochimique (ECSA) de l’électrocatalyseur peut être calculée, ce qui est la surface d’activité électrochimique par unité de masse de platine, généralement mesurée en m²/g. La formule de calcul est la suivante :
ECSA=Q/(mC)
Q=S/u
où Q est la charge totale du pic de désorption de l’hydrogène dans la courbe CV après élimination de la double couche, m est la charge de Pt sur l’électrode, C est la capacité d’adsorption unitaire d’une monocouche d’hydrogène sur la surface du Pt (210μC/cm²), S est la surface intégrée du pic de désorption de l’hydrogène dans la courbe CV, et u est la vitesse de balayage lors du test CV. L’ECSA est l’un des paramètres importants pour évaluer les électrocatalyseurs à base de platine.
Remarque : En savoir plus sur la voltamétrie cyclique
Voltamétrie à balayage linéaire
La voltamétrie à balayage linéaire (LSV) consiste à appliquer un balayage de potentiel linéaire (où le potentiel change linéairement avec le temps) entre l’électrode de travail et l’électrode de référence, tout en mesurant le courant circulant entre l’électrode de travail et l’électrode auxiliaire pour obtenir une courbe de polarisation. Une courbe de polarisation typique de la réaction de réduction de l’oxygène (ORR) peut être divisée en trois régions : la région de contrôle cinétique, la région de contrôle cinétique-diffusion mixte, et la région de contrôle de la diffusion.
Région de contrôle cinétique : Dans cette région, la vitesse de la réaction ORR est relativement lente, entraînant un courant faible ou presque négligeable. À mesure que le potentiel diminue, la densité de courant augmente lentement.
Région de contrôle cinétique-diffusion mixte : À mesure que le potentiel continue de diminuer, la vitesse de la réaction ORR s’accélère, comme en témoigne une augmentation significative de la densité de courant avec la diminution du potentiel. Dans cette région, la vitesse de l’ORR est déterminée à la fois par la vitesse cinétique intrinsèque de la réaction et par la vitesse de diffusion de l’oxygène.
Région de contrôle de la diffusion : Dans cette région, la vitesse cinétique intrinsèque de la réaction dépasse la vitesse de diffusion de l’oxygène. Cela signifie que la vitesse de réduction de l’oxygène sur la surface de l’électrocatalyseur dépasse de loin la vitesse à laquelle l’oxygène peut diffuser de l’électrolyte en vrac vers la surface de l’électrocatalyseur. En conséquence, la vitesse de l’ORR est contrôlée par la vitesse de diffusion de l’oxygène, et la courbe de polarisation dans cette région forme un plateau de densité de courant limite où la densité de courant ne change pas avec le potentiel.
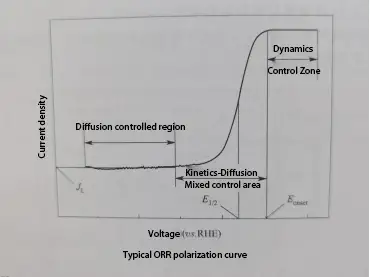
Dans une courbe de polarisation ORR, deux paramètres peuvent indiquer l’activité électrocatalytique du catalyseur : le potentiel de début (Eonset) et le potentiel à mi-onde (E1/2).
Potentiel de début (Eonset) :
Le potentiel de début est la valeur de potentiel à la frontière entre la région de contrôle cinétique et la région de contrôle cinétique-diffusion mixte dans la courbe de polarisation. Différentes méthodes de mesure sont utilisées dans diverses études, notamment :
La valeur de potentiel à 5 % de la densité de courant limite.
La valeur de potentiel à une densité de courant de 0,1 mA/cm².
L’intersection de la tangente au point de pente maximale dans la région de contrôle cinétique-diffusion mixte avec la densité de courant nulle.
Potentiel à mi-onde (E1/2) :
Le potentiel à mi-onde est la valeur de potentiel à laquelle la densité de courant est la moitié de la densité de courant limite. Ce paramètre reflète l’activité potentielle intermédiaire de l’électrocatalyseur dans l’ORR.
Pour calculer le nombre d’électrons transférés lors du processus ORR pour différentes vitesses de rotation de l’électrode, l’équation de Koutecky-Levich (K-L) est utilisée :
1/ID=1/IK+1/(Bw1/2)
où ID est le courant mesuré, IK est le courant cinétique, w est la vitesse de rotation de l’électrode (tr/min ou rad/s), et B est l’inverse de la pente, calculé en utilisant l’équation de Levich :
B=0,62nFAC0D02/3u-1/6
où n est le nombre d’électrons transférés par molécule d’oxygène, F est la constante de Faraday (96485 C/mol), D0 est le coefficient de diffusion de l’O2, C0 est la concentration d’O2 dans l’électrolyte, et ν est la viscosité cinématique de l’électrolyte.
L’introduction ci-dessus démontre les applications importantes des différentes méthodes de test de performance des électrocatalyseurs dans la recherche électrochimique. En utilisant ces méthodes de manière exhaustive, les chercheurs peuvent caractériser plus précisément les performances des électrocatalyseurs, faisant ainsi avancer la technologie des piles à combustible et d’autres applications électrochimiques.
Articles connexes :
Mécanisme de la réaction ORR des piles à combustible à membrane échangeuse de protons
Réactions aux électrodes dans les piles à combustible : Anode et Cathode

