Genaue Leistungsmethoden zur Charakterisierung sind entscheidend für das Studium der Elektrokatalysatorleistung. Dieser Artikel beschreibt mehrere gängige Methoden zur Leistungsmessung von Elektrokatalysatoren, einschließlich Einzelbatterie, rotierende Scheibenelektrode (RDE) und rotierende Ring-Scheibenelektrode (RRDE) Tests, zyklische Voltammetrie (CV) und lineare Sweep-Voltammetrie (LSV). Jede Methode hat ihre einzigartigen Vorteile und Anwendungsbereiche. Das Verständnis der grundlegenden Prinzipien und Anwendungsszenarien dieser Methoden hilft, die Leistung von Elektrokatalysatoren umfassender und genauer zu bewerten, und fördert damit die Forschung an Brennstoffzellen und anderen elektrochemischen Anwendungen.
Einzelbatterie
Eine wichtige Methode zur Charakterisierung der Leistung von Elektrokatalysatoren besteht darin, den Elektrokatalysator, Alkohol, Wasser und protonenleitendes Harz in einem bestimmten Verhältnis zu mischen, um eine Suspension zu bilden. Diese Suspension wird dann auf eine Protonenaustauschmembran oder eine Gasdiffusionsschicht gesprüht oder gestrichen, und durch Heißpressen wird eine Membranelektrode erhalten. Die katalytische Leistung wird mit der Einzelbatteriemethode bewertet, die den Vergleich verschiedener Elektrokatalysatoren ermöglicht.
Diese Methode ist besonders im Bereich der Brennstoffzellenforschung sehr effektiv, da sie die elektrochemische Leistung von Katalysatoren unter realen Arbeitsbedingungen bewerten kann und Faktoren wie die Verteilung des Katalysators in der Membranelektrode, Protonenleitfähigkeit und Gasdiffusion berücksichtigt. Allerdings beeinflussen die Herstellungsbedingungen der Membranelektrode die Bewertung der Elektrokatalysatorleistung erheblich. Einzelbatterie misst die Gesamtleistung des Elektrokatalysators, erlaubt jedoch keine eingehende Untersuchung der katalytischen Reaktionsmechanismen auf der Oberfläche des Elektrokatalysators.
Rotierende Scheibenelektrode und rotierende Ring-Scheibenelektrode Methoden
Die rotierende Scheibenelektrode (RDE) und die rotierende Ring-Scheibenelektrode (RRDE) sind zwei gängige elektrochemische Testmethoden zur Bewertung der Leistung von Elektrokatalysatoren. Diese Methoden können die anfängliche elektrochemische Leistung von Elektrokatalysatoren wie Aktivität, Stabilität und Reaktionsmechanismen in relativ kurzer Zeit schnell bewerten. Sie sind besonders geeignet für das Studium der Mechanismen elektrochemischer Reaktionen, wie der Sauerstoffreduktionsreaktion (ORR). Durch die Steuerung der Rotationsgeschwindigkeit können diese Methoden den Massenübertragungsprozess präzise steuern und stabile und hoch reproduzierbare Testbedingungen bieten.
Rotierende Ring-Scheibenelektrode (RRDE): Dies ist eine elektrochemische Messtechnik, die aus der RDE entwickelt wurde und sich besonders zur Detektion von Zwischenprodukten in elektrochemischen Reaktionen eignet. Wenn eine Reduktionsreaktion an der Scheibenelektrode auftritt, werden die erzeugten Zwischenprodukte durch den Lösungsfluss zur Ringe Elektrode transportiert. Durch das Anlegen eines Potentials an die Ringelektrode, das die Zwischenprodukte oxidieren kann, kann der Oxidationsreaktionsstrom an der Ringelektrode detektiert werden, wodurch der Reaktionsweg sowie die Bildung und der Verbrauch von Zwischenprodukten weiter untersucht werden können.
Im Vergleich zu Einzelbatteriemethoden sind RDE und RRDE besser für vorläufige Leistungsevaluationen und Reaktionsmechanismusstudien geeignet, während Einzelbatterien eine umfassendere Bewertung der Gesamtleistung des Katalysators unter realen Arbeitsbedingungen ermöglichen. Für ORR-Tests können die Produktionsrate von H2O2 und die Elektronentransferzahl (n) während des Sauerstoffreduktionsprozesses am Elektrokatalysator anhand der folgenden Formel berechnet werden:
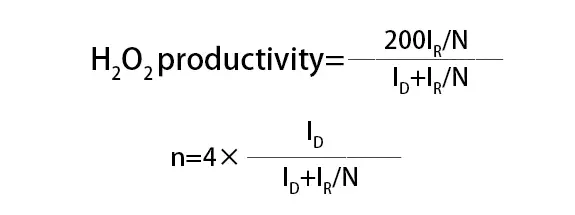
wo ID der Faradaische Strom an der Scheibenelektrode ist, IR der Faradaische Strom an der Ringe Elektrode ist und N der Sammeleffizienz der Scheibenelektrode für H2O2 ist.
Zyklische Voltammetrie (CV)
Zyklische Voltammetrie (CV) ist eine häufig verwendete elektrochemische Transient-Experiment-Methode zur Untersuchung von Reaktionskinetik und -mechanismen. Durch die Steuerung des Elektrodenpotentials zum Scannen in einer dreieckigen Wellenform mit unterschiedlichen Raten über die Zeit treten abwechselnd Reduktions- und Oxidationsreaktionen an der Elektrode auf, und die Strom-Spannungskurve, bekannt als zyklische Voltammetrie, wird aufgezeichnet.
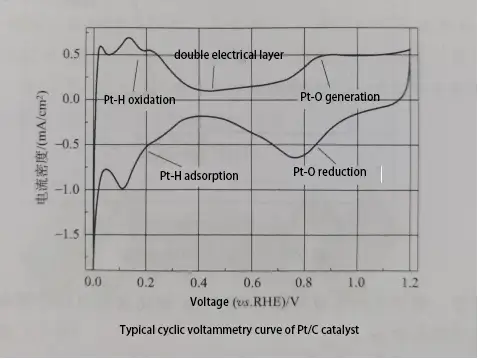
Die Abbildung zeigt eine typische CV-Kurve für einen Pt/C-Katalysator, unterteilt in fünf Teile: Wasserstoffadsorptionsspitze, Doppelschichtbereich, Oberflächen-Pt-Oxidationsspitze, Pt-Oxid-Reduktionsspitze und Wasserstoffdesorptionsspitze. Aus der Wasserstoffdesorptionskurve an der Pt-Elektrode in der CV-Kurve kann die elektrochemisch aktive Oberfläche (ECSA) des Elektrokatalysators berechnet werden, die die Oberfläche der elektrochemischen Aktivität pro Masseneinheit Platin ist, üblicherweise gemessen in m²/g. Die Berechnungsformel lautet wie folgt:
ECSA=Q/(mC)
Q=S/u
wo Q die Gesamtladung der Wasserstoffdesorptionsspitze in der CV-Kurve nach Entfernen der Doppelschicht ist, m die Beladung von Pt auf der Elektrode, C die Einheitsadsorptionskapazität einer Monoschicht Wasserstoff auf der Pt-Oberfläche (210 μC/cm²), S die integrierte Fläche der Wasserstoffdesorptionsspitze in der CV-Kurve und u die Scanrate während des CV-Tests ist. ECSA ist einer der wichtigen Parameter zur Bewertung von platinhaltigen Elektrokatalysatoren.
Hinweis: Erfahren Sie mehr über zyklische Voltammetrie
Lineare Sweep-Voltammetrie
Bei der linearen Sweep-Voltammetrie (LSV) wird ein linearer Potenzialverlauf (bei dem sich das Potenzial linear mit der Zeit ändert) zwischen der Arbeitselektrode und der Referenzelektrode angelegt, während der Stromfluss zwischen der Arbeitselektrode und der Hilfselektrode gemessen wird, um eine Polarisationskurve zu erhalten. Eine typische Polarisationskurve der Sauerstoffreduktionsreaktion (ORR) kann in drei Bereiche unterteilt werden: den kinetischen Kontrollbereich, den gemischten kinetisch-diffusiven Kontrollbereich und den diffusionskontrollierten Bereich.
Kinetischer Kontrollbereich: In diesem Bereich ist die ORR-Reaktionsrate relativ langsam, was zu einem kleinen oder fast vernachlässigbaren Strom führt. Mit abnehmendem Potenzial steigt die Stromdichte langsam an.
Gemischter kinetisch-diffusiver Kontrollbereich: Mit weiter abnehmendem Potenzial beschleunigt sich die ORR-Reaktionsrate, was sich in einem signifikanten Anstieg der Stromdichte bei abnehmendem Potenzial zeigt. In diesem Bereich wird die ORR-Rate sowohl durch die intrinsische kinetische Rate der Reaktion als auch durch die Diffusionsrate von Sauerstoff bestimmt.
Diffusionskontrollierter Bereich: In diesem Bereich übertrifft die intrinsische kinetische Rate der Reaktion die Diffusionsrate von Sauerstoff. Dies bedeutet, dass die Rate der Sauerstoffreduktion auf der Oberfläche des Elektrokatalysators die Rate, mit der Sauerstoff aus dem Bulk-Elektrolyt zur Oberfläche des Elektrokatalysators diffundieren kann, bei weitem übersteigt. Folglich wird die ORR-Rate durch die Diffusionsrate von Sauerstoff kontrolliert, und die Polarisationskurve in diesem Bereich bildet ein begrenzendes Stromdichteplateau, bei dem sich die Stromdichte nicht mit dem Potenzial ändert.
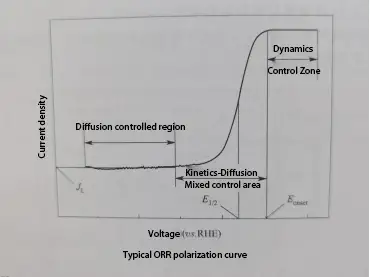
In einer ORR-Polarisationskurve können zwei Parameter die elektrokatalytische Aktivität des Katalysators anzeigen: Anfangspotenzial (Eonset) und Halbwellenpotenzial (E1/2).
Anfangspotenzial (Eonset):
Das Anfangspotenzial ist der Potenzialwert an der Grenze zwischen dem kinetischen Kontrollbereich und dem gemischten kinetisch-diffusiven Kontrollbereich in der Polarisationskurve. Verschiedene Messmethoden werden in verschiedenen Studien verwendet, einschließlich:
Der Potenzialwert bei 5% der begrenzenden Stromdichte.
Der Potenzialwert bei einer Stromdichte von 0,1 mA/cm².
Der Schnittpunkt der Tangente am Punkt der maximalen Steigung im gemischten kinetisch-diffusiven Kontrollbereich mit der Stromdichte von Null.
Halbwellenpotenzial (E1/2):
Das Halbwellenpotenzial ist der Potenzialwert, bei dem die Stromdichte die Hälfte der begrenzenden Stromdichte beträgt. Dieser Parameter spiegelt die mittlere Potenzialaktivität des Elektrokatalysators bei der ORR wider.
Um die Anzahl der während des ORR-Prozesses übertragenen Elektronen bei verschiedenen Elektrodenrotationsgeschwindigkeiten zu berechnen, wird die Koutecky-Levich (K-L) Gleichung verwendet:
1/ID=1/IK+1/(Bw1/2)
wo ID der gemessene Strom ist, IK der kinetische Strom, w die Elektrodenrotationsgeschwindigkeit (rpm oder rad/s) und B der Kehrwert der Steigung ist, berechnet mit der Levich-Gleichung:
B=0,62nFAC0D02/3u-1/6
wo n die Anzahl der pro Sauerstoffmolekül übertragenen Elektronen ist, F die Faraday-Konstante (96485 C/mol), D0 der Diffusionskoeffizient von O2, C0 die Konzentration von O2im Elektrolyt und ν die kinematische Viskosität des Elektrolyts ist.
Die obige Einführung zeigt die wichtigen Anwendungen verschiedener Methoden zur Leistungsmessung von Elektrokatalysatoren in der elektrochemischen Forschung. Durch die umfassende Nutzung dieser Methoden können Forscher die Leistung von Elektrokatalysatoren genauer charakterisieren und somit die Technologie von Brennstoffzellen und anderen elektrochemischen Anwendungen vorantreiben.
Ähnliche Artikel:
ORR-Reaktionsmechanismus von Protonenaustauschmembran-Brennstoffzellen
Electrode Reactions in Fuel Cells: Anode and Cathode

