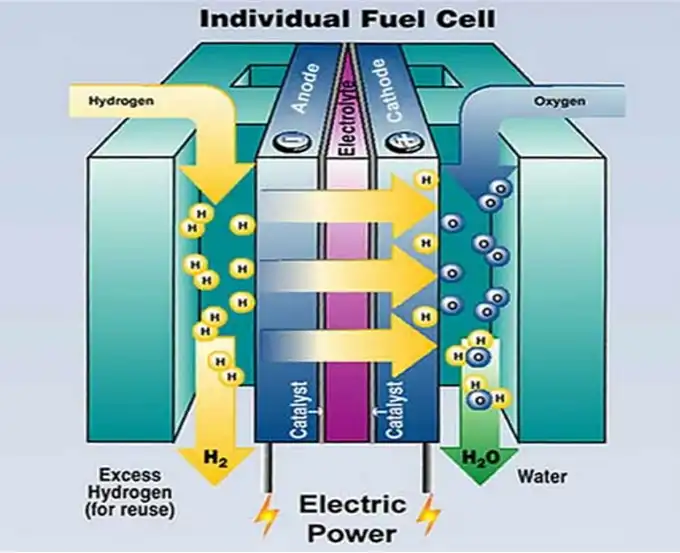
Le reazioni degli elettrodi si riferiscono alle reazioni chimiche che avvengono agli elettrodi dove gli elettroni vengono persi o guadagnati. La reazione in cui gli elettroni vengono persi è chiamata reazione anodica, e l’elettrodo dove questa reazione avviene è chiamato anodo. La reazione in cui gli elettroni vengono guadagnati è chiamata reazione catodica, e l’elettrodo dove questa reazione avviene è chiamato catodo.
Con questa semplice spiegazione, crediamo che ora tutti abbiano una comprensione di base delle reazioni degli elettrodi. Successivamente, approfondiremo i concetti di reazioni degli elettrodi, reazioni anodiche e reazioni catodiche.
Panoramica di Base delle Reazioni degli Elettrodi
Le reazioni degli elettrodi sono principalmente effettuate in varie celle a combustibile e celle elettrolitiche. Se l’energia necessaria per guidare la reazione elettrochimica è fornita da una fonte di alimentazione esterna, si parla di reazione elettrochimica in una cella elettrolitica. Se il sistema converte spontaneamente la sua energia chimica libera in energia elettrica, si parla di reazione elettrochimica in una cella a combustibile.
Il processo di carica nelle celle chimiche primarie (batterie) appartiene alla prima categoria. Indipendentemente dal fatto che sia in celle elettrolitiche o celle a combustibile, le reazioni elettrochimiche coinvolgono almeno due tipi di processi elettrodici: il processo anodico e il processo catodico. Poiché i processi elettrodici coinvolgono il trasferimento di carica tra l’elettrodo e l’elettrolita, e gli elettroni liberi non esistono nell’elettrolita, alcuni componenti subiranno ossidazione o riduzione all’interfaccia “elettrodo/elettrolita” quando passa corrente, risultando in reazioni chimiche.
Velocità di Reazione dell’Elettrodo
La velocità di reazione dell’elettrodo è la quantità di prodotti di reazione generati per unità di area dell’elettrodo per unità di tempo. Ad esempio, in una reazione elettrolitica, l’unità della quantità di prodotto è mol/(m²·s).
Secondo le leggi dell’elettrolisi di Faraday, la quantità di prodotti elettrolitici è proporzionale alla carica elettrica che passa attraverso l’elettrodo. La quantità di carica che passa per unità di tempo è la corrente, e la corrente per unità di area è la densità di corrente. Basandosi su questa relazione, la velocità di reazione dell’elettrodo può essere espressa in termini di densità di corrente. Maggiore è la densità di corrente, più veloce è la velocità di reazione dell’elettrodo; d’altra parte, la polarizzazione dell’elettrodo (sovrapotenziale) aumenta anche.
La velocità di reazione dell’elettrodo è strettamente legata al potenziale dell’elettrodo. Quando un elettrodo è al potenziale di equilibrio (senza corrente netta che lo attraversa), le velocità della reazione anodica (reazione di ossidazione) e della reazione catodica (reazione di riduzione) sono uguali. La densità di corrente della reazione anodica e la densità di corrente della reazione catodica sono le stesse, il che è chiamato densità di corrente di scambio (anche semplicemente nota come corrente di scambio).
Per un dato elettrodo in condizioni specifiche (materiale e stato superficiale), con concentrazione della soluzione e temperatura costanti, la densità di corrente di scambio è una costante. Riflette la capacità di reazione dell’elettrodo al potenziale di equilibrio. Quando la densità di corrente di scambio in un elettrodo è grande, anche le velocità delle reazioni anodiche e catodiche sono grandi.
Quando un elettrodo è in uno stato polarizzato, la densità di corrente della reazione anodica (velocità di reazione) e la densità di corrente della reazione catodica non sono le stesse. In altre parole, le densità di corrente di polarizzazione di queste due reazioni elettrodiche opposte differiscono, risultando in una corrente netta misurabile (anche nota come corrente esterna) che passa attraverso l’elettrodo. Il suo valore è uguale alla differenza tra le densità di corrente delle reazioni anodica e catodica, manifestandosi come una reazione di ossidazione o riduzione unidirezionale. In questa situazione, indipendentemente dal tipo di reazione chimica, un elettrodo con una maggiore densità di corrente può raggiungere una maggiore densità di corrente netta, cioè una velocità di reazione elettrodica unidirezionale più alta, sotto un potenziale di polarizzazione (sovrapotenziale) più piccolo. Al contrario, se la densità di corrente di scambio è molto piccola, è necessario un potenziale di polarizzazione (sovrapotenziale) considerevole per raggiungere una maggiore densità di corrente netta, cioè una velocità di reazione elettrodica più alta.
Reazione Anodica
Nelle celle a combustibile, la reazione anodica si riferisce alla reazione di ossidazione dell’idrogeno (HOR) sulla superficie dell’elettrocatalizzatore anodico. Quando il platino è utilizzato come catalizzatore anodico, il meccanismo dell’ossidazione elettrocatalitica dell’idrogeno sulla superficie del platino include generalmente tre passaggi di base (dove Pt rappresenta la superficie del catalizzatore di Pt, H-Pt rappresenta un atomo di idrogeno adsorbito sulla superficie di Pt e e- rappresenta un elettrone):
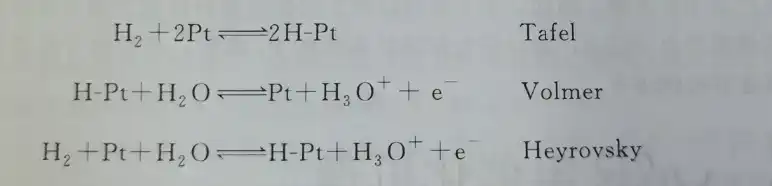
Generalmente, qualsiasi via di reazione includerà la reazione di Volmer, quindi la reazione HOR segue due vie più basilari: la via Tafel-Volmer e la via Heyrovsky-Volmer. Per la via Tafel-Volmer, H₂ subisce un’adsorbimento dissociativo sulla superficie di Pt (reazione di Tafel). I due atomi di idrogeno adsorbiti perdono ciascuno un elettrone e si staccano dalla superficie di Pt, formando due protoni e due elettroni. Per la via Heyrovsky-Volmer, la reazione di ossidazione a singolo elettrone di H₂ e la chemiadsorbimento avvengono simultaneamente, generando un H adsorbito, un protone e un elettrone. L’H adsorbito può continuare a subire reazioni di ossidazione a singolo elettrone.
A causa della cinetica molto veloce del processo di ossidazione di H₂ sul metallo Pt, il Pt è attualmente il miglior catalizzatore per le reazioni catalitiche HOR. Tipicamente, vengono utilizzati catalizzatori di Pt/C altamente dispersi, e le prestazioni della cella non diminuiscono significativamente anche quando il carico di Pt è ridotto a 0,05 mg/cm².
Reazione Catodica
Nelle celle a combustibile, la reazione catodica si riferisce alla reazione di riduzione dell’ossigeno (ORR) sulla superficie dell’elettrocatalizzatore catodico. La reazione di riduzione a quattro elettroni di O₂ in un elettrolita acido può essere espressa come:
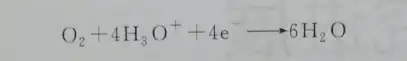
Il potenziale di equilibrio termodinamico per la ORR catodica è 1,23V (vs. NHE, 298K). La differenza tra il potenziale dell’elettrodo ORR e il potenziale di equilibrio è il sovrapotenziale che guida questa reazione. Il sovrapotenziale è direttamente correlato all’efficienza operativa della cella a combustibile; maggiore è il sovrapotenziale, minore è l’efficienza operativa della cella a combustibile. Il ruolo di un elettrocatalizzatore efficiente è quello di ottenere la densità di corrente richiesta a un sovrapotenziale inferiore.
Tuttavia, anche sugli elettrodi di platino, che hanno le migliori prestazioni di riduzione dell’ossigeno, il sovrapotenziale per la riduzione catodica dell’ossigeno è solitamente superiore a 0,25V. Pertanto, per la tecnologia PEMFC, il sovrapotenziale catodico durante il funzionamento è tipicamente alto fino a 0,4V per raggiungere la corrente di uscita nominale. Questo può essere ottenuto solo quando il catodo contiene una quantità significativa di catalizzatori di metalli preziosi. Gasteiger e altri hanno scoperto che, utilizzando il catalizzatore Pt/C con le migliori prestazioni come catalizzatore catodico, il carico di Pt deve essere vicino a 0,4 mg/cm². Ridurre ulteriormente il carico di Pt porterebbe a una diminuzione della tensione della cella a causa delle perdite cinetiche della ORR, specialmente a basse densità di corrente. Pertanto, il catodo richiede un carico di Pt maggiore rispetto all’anodo per mantenere le prestazioni della cella.
A causa della disponibilità limitata e dell’alto costo del Pt, è essenziale ridurre significativamente il carico di Pt al catodo per promuovere l’industrializzazione su larga scala dei veicoli elettrici alimentati da celle a combustibile a membrana di scambio protonico (PEMFC).
Nota: Meccanismo della reazione ORR delle Celle a combustibile con membrana a scambio protonico
Sintesi:
Le reazioni degli elettrodi nelle celle a combustibile, in particolare le reazioni anodiche e catodiche, sono il nucleo delle prestazioni della cella. Attraverso un’analisi dettagliata della reazione di ossidazione dell’idrogeno (HOR) all’anodo e della reazione di riduzione dell’ossigeno (ORR) al catodo, possiamo comprendere meglio e ottimizzare l’efficienza e la durata delle celle a combustibile.
In futuro, con i progressi della tecnologia, si prevede che gli scienziati svilupperanno materiali catalizzatori più efficienti e convenienti, riducendo significativamente il costo di produzione delle celle a combustibile e promuovendone l’applicazione commerciale su larga scala in campi come i veicoli elettrici. Che sia migliorando l’efficienza di utilizzo dei catalizzatori esistenti a base di platino o esplorando nuovi sistemi catalitici, continueremo a sforzarci di raggiungere l’obiettivo della neutralità carbonica.
Articoli Correlati:
Quali sono le principali differenze tra PEM fuel cell, FCAFC, MCFC, SOFC e DMFC?
L’influenza della struttura della Piastra bipolare sulle prestazioni delle celle a combustibile