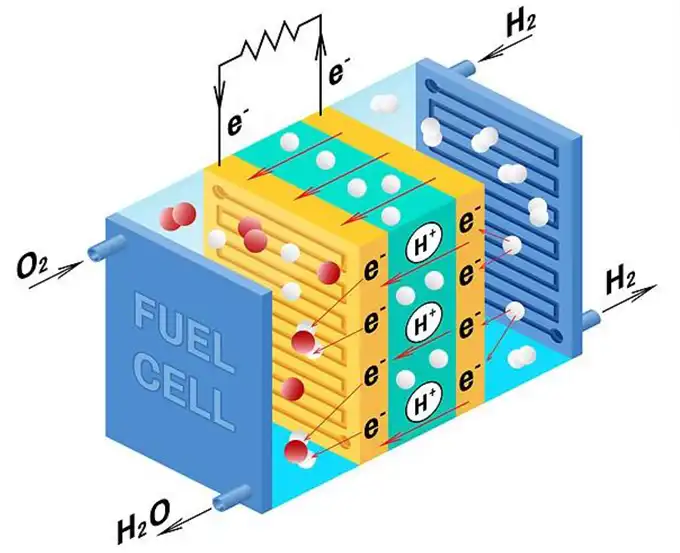
Con la trasformazione del panorama energetico mondiale e gli obiettivi di “picco del carbonio” e “neutralità del carbonio”, l’energia a idrogeno, con la più alta densità di energia di massa e zero emissioni di carbonio, ha attirato sempre più attenzione. Le Celle a combustibile con membrana a scambio protonico (PEMFC) sono attualmente una tecnologia di utilizzo dell’energia a idrogeno altamente promettente grazie ai loro vantaggi di bassa temperatura di esercizio, avvio rapido e assenza di inquinamento, rendendole ampiamente applicabili in aerospaziale, navi marittime, automobili, fonti di alimentazione stazionarie e molti altri campi.
Nota: Applicazioni Pratiche delle Celle a Combustibile a Membrana a Scambio Protonico
Ad oggi, i catalizzatori a base di platino rimangono la scelta principale per i catalizzatori nelle PEMFC grazie alle loro prestazioni superiori di reazione di riduzione dell’ossigeno (ORR) e di reazione di ossidazione dell’idrogeno (HOR). Tuttavia, il platino è un metallo raro e prezioso, e il suo alto costo limita la commercializzazione delle celle a combustibile. Secondo la previsione del Dipartimento dell’Energia degli Stati Uniti (DOE) per il 2022 sui camion pesanti a celle a combustibile a idrogeno, quando la spedizione annuale degli stack PEMFC raggiungerà le 50.000 unità, il costo dei catalizzatori rappresenterà il 59% del costo totale di produzione degli stack.
La reazione di riduzione dell’ossigeno (ORR) è uno dei passaggi chiave dell’intero processo elettrochimico, avendo un impatto decisivo sulla tensione di uscita e sull’efficienza delle celle a combustibile. Tuttavia, la quantità di catalizzatore per l’ORR è relativamente alta, stimata a rappresentare l’80% o più del totale. Inoltre, la sua reversibilità è scarsa, la polarizzazione è grave e il processo cinetico è un processo complesso a quattro elettroni. Diverse specie intermedie sono coinvolte nella reazione, come H2O2 e intermedi adsorbiti contenenti ossigeno (O2,ad e OHad, ecc.). Questi intermedi causano un sovrapotenziale nel processo ORR che può raggiungere fino a 0,2V o anche di più. Pertanto, sviluppare catalizzatori ORR ad alta attività con un basso contenuto di platino è cruciale per promuovere l’applicazione su larga scala delle celle a combustibile.
Attualmente, ci sono numerosi rapporti sul meccanismo dell’ORR e sulla ricerca sperimentale, ma variano leggermente. Questi includono:
Via a due elettroni: Questa coinvolge principalmente due passaggi principali: riduzione parziale della molecola di ossigeno per produrre perossido di idrogeno, che viene poi ulteriormente ridotto a acqua. Questo meccanismo può essere rappresentato dai seguenti passaggi:
O2+2H++2e–→H2O2
H2O2+2H++2e–→2H2O
Questo percorso è noto anche come un processo a quattro elettroni in due fasi, con il perossido di idrogeno (H2O2) come intermedio. La presenza di perossido di idrogeno può portare all’avvelenamento del catalizzatore e alla riduzione dell’efficienza.
Via sequenziale a singolo elettrone: In questa via, la riduzione della molecola di ossigeno avviene attraverso passaggi consecutivi di trasferimento di singoli elettroni, ognuno dei quali forma un intermedio a singolo elettrone, come:
O2+e–→O2–
O2–+e–→O22-
O22-+e–→2O–
2O–+4H++2e–→2H2O
Questo percorso coinvolge molteplici passaggi di trasferimento di singoli elettroni, producendo vari intermedi, che complicano il processo di reazione.
Via diretta a quattro elettroni: Questo è il percorso di reazione più ideale perché evita la formazione di intermedi dannosi e riduce direttamente la molecola di ossigeno a acqua:
O2+4H++4e–→2H2O
Via a quattro elettroni in fasi: In questo percorso, il processo di riduzione dell’ossigeno può essere suddiviso in diversi passaggi più piccoli, ognuno dei quali coinvolge l’aggiunta graduale di protoni ed elettroni, formando diversi intermedi:
O2+H++e–→HO2
HO2+H++e–→H2O2
H2O2+H++e–→HO+H2O
HO+H++e–→H2O
Questo percorso illustra l’aggiunta graduale di protoni ed elettroni, nonché la formazione e la conversione di vari intermedi.
Le spiegazioni di cui sopra ruotano principalmente intorno agli studi teorici del “processo a quattro elettroni”. Esistono molti altri studi teorici diversi, che non verranno dettagliati qui. Le varie teorie di ricerca sulla reazione di riduzione dell’ossigeno (ORR) dimostrano la complessità e la diversità dei percorsi di reazione, con il processo diretto a quattro elettroni che è il percorso più ideale.
Nel processo di reazione diretta a quattro elettroni, l’O2 si adsorbe prima sulla superficie dell’elettrocatalizzatore, formando ossigeno adsorbito. L’ossigeno adsorbito reagisce attraverso diversi percorsi: Quando l’ossigeno adsorbito viene direttamente ridotto elettrochimicamente a H2O tramite il percorso a quattro elettroni, viene chiamato “processo diretto a quattro elettroni”. Quando l’ossigeno adsorbito forma il prodotto intermedio H2O2 tramite il percorso a due elettroni e l’H2O2 desorbe direttamente dalla superficie del catalizzatore, viene chiamato “processo di riduzione a due elettroni”. Se l’H2O2 continua a essere ridotto a H2O, viene chiamato “processo indiretto a quattro elettroni” o “processo H2O2“. Se l’H2O2 si decompone sulla superficie dell’elettrocatalizzatore (cataliticamente o chimicamente) in H2O e O2, e l’O2 risultante continua la reazione di riduzione dell’O2, questo processo viene chiamato “processo di riduzione elettrochimico-chimico”.
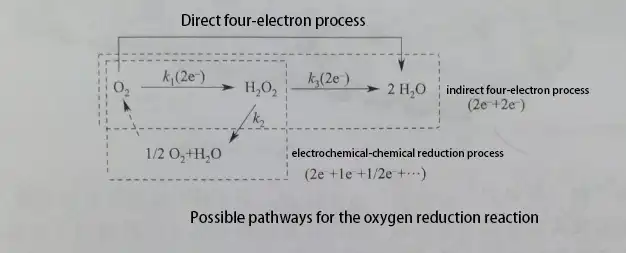
Meccanismo della ORR sulla superficie del Pt
Il complesso processo della ORR coinvolge molteplici fasi di trasferimento di elettroni e protoni. Studiando questo processo, è possibile determinare le fasi che determinano la velocità della cinetica della ORR e identificare le cause del sovrapotenziale. Pertanto, comprendere il processo della ORR a livello atomico è cruciale per progettare elettrocatalizzatori ad alte prestazioni. Sono state condotte ricerche estensive sui meccanismi di reazione della ORR su diverse superfici di elettrocatalizzatori, con Pt/C che rimane uno degli elettrocatalizzatori con alta attività catalitica per la ORR. Di conseguenza, il meccanismo di reazione di riduzione dell’O2 sulla superficie dell’elettrocatalizzatore Pt è stato quello più ampiamente studiato.
Esiste una comprensione completa della relazione tra la cinetica della reazione della ORR e le proprietà elettroniche delle superfici metalliche. Tuttavia, la ricerca futura deve continuare ad approfondire per sviluppare catalizzatori ORR più efficienti e stabili. La ricerca sul meccanismo della ORR può essere riassunta come segue:
Innanzitutto, l’O2 diffonde sulla superficie dell’elettrocatalizzatore, formando molecole di ossigeno adsorbite (O2*, dove * rappresenta i siti attivi sulla superficie del catalizzatore). Basandosi sui passaggi di rottura del legame O-O, il meccanismo di riduzione dell’O2* può essere suddiviso in tre percorsi:
Percorso dissociativo: il legame O-O si rompe direttamente per formare intermedi O*, che vengono successivamente ridotti a OH* e H2O*.
Percorso associativo: l’O2* viene prima ridotto a OOH*. Poi, il legame O-O in OOH* si rompe per formare intermedi O* e OH*, che continuano a essere ridotti.
Percorso del perossido (Percorso associativo secondario): l’O2* viene ridotto sequenzialmente a OOH* e HOOH* prima che il legame O-O si rompa per formare OH*. Gli intermedi continuano a essere ridotti.
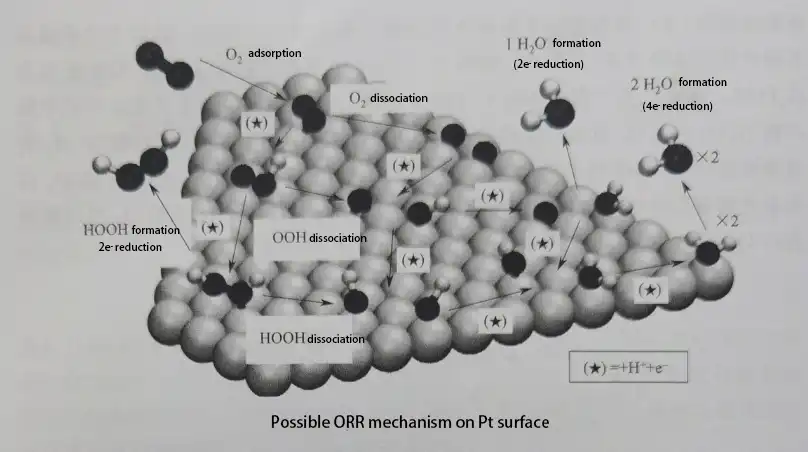
Gli intermedi come O*, OOH* e OH* sono cruciali nel processo della ORR. È difficile ottenere prove sperimentali dirette per questi intermedi, ma i calcoli teorici hanno fornito prove sostanziali. I ricercatori hanno utilizzato i calcoli della teoria del funzionale della densità (DFT) per dimostrare che l’adsorbimento di specie di ossigeno sulla superficie dell’elettrocatalizzatore è la causa del sovrapotenziale. A voltaggi elevati, le specie di ossigeno adsorbite sulla superficie dell’elettrocatalizzatore sono stabili, rendendo difficile il trasferimento di protoni ed elettroni. Quando il voltaggio diminuisce, la stabilità dell’ossigeno adsorbito diminuisce, permettendo la reazione di ossidazione.
L’energia di legame tra le specie di ossigeno e la superficie dell’elettrocatalizzatore determina direttamente l’attività catalitica dell’elettrocatalizzatore. Per un elettrocatalizzatore altamente attivo, l’energia di legame tra la superficie e i prodotti intermedi dovrebbe essere appropriata: se l’energia di legame di adsorbimento è troppo debole, ostacolerà il trasferimento di elettroni e protoni all’ossigeno adsorbito; se l’energia di legame di adsorbimento è troppo forte, l’H2O prodotto sarà difficile da desorbire, occupando siti attivi e impedendo l’ulteriore adsorbimento dell’O2, riducendo così l’attività ORR dell’elettrocatalizzatore.
La ragione fondamentale della differenza nell’energia di legame tra gli intermedi e le diverse superfici di elettrocatalizzatori risiede nella struttura elettronica relativa al livello di Fermi (l’orbitale più alto occupato). Più alto è il posizionamento della banda d del metallo, più forte è l’interazione tra la superficie dell’elettrocatalizzatore e gli intermedi. Pertanto, quando l’energia di legame tra gli intermedi e l’elettrocatalizzatore è appropriata, la struttura elettronica è ottimizzata, risultando in una maggiore attività catalitica per la ORR.
La relazione tra l’energia di legame delle specie adsorbite (O*, OOH*, OH*) su diverse superfici di elettrocatalizzatori metallici e l’attività di riduzione dell’ossigeno forma un “diagramma a vulcano”. Tra molti metalli, il Pt, rispetto ad altri metalli (come Fe, Co, Ni, ecc.), ha una forza di energia di legame relativamente adeguata con O*, OOH* e OH*, portando ad un’elevata attività ORR.
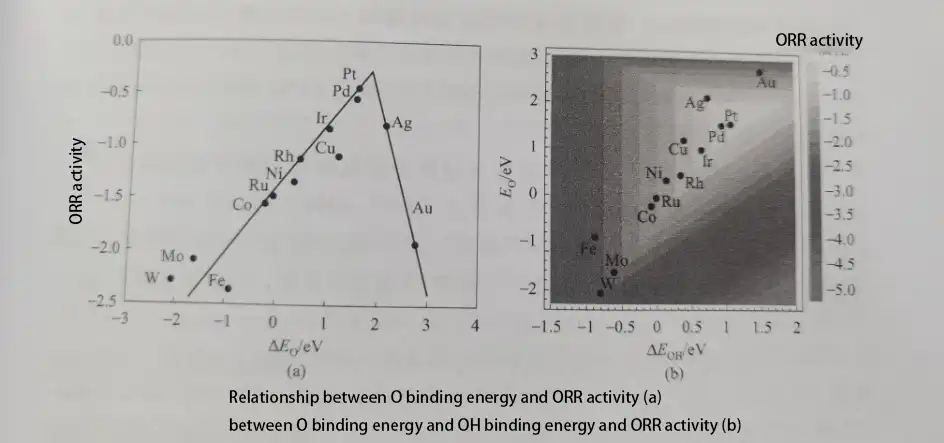
Secondo questo diagramma, possiamo vedere che l’energia di legame tra Pt e l’ossigeno adsorbito non è la più ottimale, ma un elettrocatalizzatore con un’energia di legame leggermente più debole rispetto al Pt mostrerebbe una maggiore attività ORR. In particolare, quando l’energia di legame di adsorbimento è più debole di 0,2 eV rispetto al Pt, l’elettrocatalizzatore avrà la massima attività ORR.
Reazione di Riduzione dell’Ossigeno su Elettrocatalizzatori a Metallo Non Prezioso
L’applicazione di elettrocatalizzatori a metallo non prezioso nella reazione di riduzione dell’ossigeno (ORR) è di notevole importanza grazie al loro basso costo e alle risorse abbondanti. Sono stati fatti significativi progressi nello studio del meccanismo della ORR dei catalizzatori a metallo non prezioso (NPMC), sebbene principalmente in ambito laboratoriale. Per raggiungere un’applicazione su larga scala, è necessaria una ricerca continua e approfondita per affrontare molte sfide tecniche. Ecco alcuni importanti avanzamenti e argomenti di ricerca in questo campo:
Progettazione e Sintesi dei Materiali:
I ricercatori stanno migliorando l’attività e la durabilità della ORR progettando e sintetizzando nuovi catalizzatori a metallo non prezioso. Ad esempio, i catalizzatori a base di carbonio derivati da strutture metal-organiche (MOF) e i materiali a base di carbonio dopato con azoto (Fe-N-C, Co-N-C) hanno dimostrato alte prestazioni catalitiche.
Caratterizzazione Strutturale e Analisi del Meccanismo:
Tecniche avanzate di caratterizzazione, come la spettroscopia di assorbimento a raggi X (XAS), la microscopia elettronica a trasmissione (TEM), la microscopia elettronica a scansione (SEM) e la spettroscopia fotoelettronica a raggi X (XPS), sono utilizzate per studiare la microstruttura e le proprietà superficiali dei catalizzatori. Queste tecniche aiutano a comprendere i siti attivi, i meccanismi catalitici e i percorsi di degrado dei catalizzatori.
Calcoli Teorici e Simulazioni:
La teoria del funzionale della densità (DFT) e le simulazioni di dinamica molecolare (MD) giocano un ruolo cruciale nella comprensione del meccanismo della ORR. Attraverso simulazioni computazionali, i ricercatori possono prevedere i siti attivi, i percorsi di reazione e le barriere energetiche, guidando la progettazione e l’ottimizzazione dei catalizzatori.
Applicazione Pratica e Valutazione delle Prestazioni:
Il test delle prestazioni dei catalizzatori a metallo non prezioso in applicazioni pratiche, come celle a combustibile e batterie al litio-aria, è un focus di ricerca chiave. I test di stabilità a lungo termine e le valutazioni delle prestazioni in condizioni operative reali verificano la praticità e l’affidabilità dei catalizzatori.
Ricerca sul Meccanismo di Degradazione:
Per migliorare la durabilità dei catalizzatori a metallo non prezioso, i ricercatori stanno esplorando i meccanismi di degradazione dei catalizzatori. Comprendere le cause della degradazione, come la lisciviazione degli ioni metallici e la corrosione della matrice di carbonio, aiuta a progettare catalizzatori più stabili.
Meccanismo della ORR su Elettrocatalizzatori a Metallo Non Prezioso
Per i catalizzatori a base di metalli di transizione-azoto-carbonio (M-N-C), i ricercatori ritengono che i loro meccanismi catalitici siano simili. Prendendo come esempio il Fe-N-C, la ORR catalizzata da Fe-N-C inizia dal Fe divalente, che potrebbe iniziare come N4FeII-OH2 in condizioni acide. L’O2 si adsorbe su N4FeII-OH2 guadagnando un elettrone e un protone, come mostrato nella seguente equazione: N4FeII-OH2-OH2+O2+H++e–→N4FeIII-O-OH+H2O. La reazione può quindi procedere tramite due percorsi:
Percorso 1: N4FeII-O-OH guadagna un protone e un elettrone, rilascia una molecola d’acqua e forma una specie di Fe-oxo ad alto valente. Continua a guadagnare elettroni e protoni, ritornando infine alla forma di Fe divalente idratato. I passaggi specifici sono i seguenti:
(1) N4FeIII-O-OH+H++e–→N4FeIV=O+H2O
(2) N4FeIV=O+H++e–→N4FeIII-OH
(3) N4FeIII-OH+H++e–→N4FeII-OH2
Percorso 2: N4FeIII-O-OH guadagna un protone e un elettrone per formare H2O2, e il sito catalitico attivo, dopo aver adsorbito una molecola d’acqua, ritorna alla forma di ferro divalente idratato, come segue:
(1) N4FeIII-O-OH+H++e–→N4FeII+H2O2
(2) N4FeII+H2O→N4FeII-OH2
Nel Percorso 1, l’O2 guadagna direttamente quattro protoni e quattro elettroni, che è il percorso diretto a quattro elettroni della ORR. Questo percorso richiede la formazione di un intermedio di Fe tetravalente. Nel Percorso 2, l’O2 guadagna solo due protoni e due elettroni, corrispondendo al percorso a due elettroni della ORR. Alcuni ricercatori suggeriscono che il Fe tetravalente sia possibile nella ORR catalizzata da Fe-N-C ma solo sotto elevati sovrapotenziali. Questo potrebbe spiegare perché i catalizzatori Fe-N-C seguono un percorso diretto a quattro elettroni a elevati sovrapotenziali e un percorso a due elettroni a bassi potenziali. Secondo questo punto di vista, poiché il CoN4 è meno propenso a formare stati di Co ad alto valente, la ORR catalizzata da CoN4 segue tipicamente il percorso a due elettroni, generando H2O2.
Conclusione:
Con il cambiamento del paradigma energetico globale verso la sostenibilità e l’adozione degli obiettivi di “picco del carbonio” e “neutralità del carbonio”, l’energia a idrogeno, in particolare attraverso le Celle a combustibile con membrana a scambio protonico (PEMFC), si distingue come una tecnologia fondamentale. Nonostante le sfide poste dalla dipendenza dai catalizzatori a base di platino, significativi progressi nella comprensione della reazione di riduzione dell’ossigeno (ORR) e nello sviluppo di catalizzatori a metallo non prezioso (NPMC) stanno aprendo la strada a soluzioni più efficienti e convenienti. Continuando a esplorare e innovare nella progettazione dei catalizzatori, nella sintesi e nella comprensione meccanicistica, possiamo sbloccare il pieno potenziale dell’energia a idrogeno e spingerla verso un’adozione commerciale diffusa. Questo percorso, caratterizzato da rigorose ricerche e scoperte tecnologiche, promette un futuro energetico più pulito e sostenibile.
Articoli correlati:
Reazioni degli Elettrodi nelle Celle a Combustibile: Anodo e Catodo