Früher haben wir die Entwicklungsereignisse von Brennstoffzellen eingeführt. Wie wir sehen können, war die Entwicklung von Brennstoffzellen im Laufe der Zeit vielfältig, was zu verschiedenen Typen und zahlreichen Klassifizierungsmethoden geführt hat. Die häufigste Klassifizierung basiert jedoch auf dem Typ des Elektrolyten, einschließlich „Protonenaustauschmembran-Brennstoffzellen“, „Alkalische Brennstoffzellen“, „Phosphorsäure-Brennstoffzellen“, „Schmelzkarbonat-Brennstoffzellen“ und „Festoxid-Brennstoffzellen“. Neben der Klassifizierung nach Elektrolyttyp gibt es auch Klassifizierungen basierend auf Reaktionstemperatur, verschiedenen Brennstoffen und anderen Methoden.
Im vorherigen Blog-Beitrag zur Entwicklung von Brennstoffzellen haben wir erwähnt, dass Protonenaustauschmembran-Brennstoffzellen (PEMFCs) sowohl in praktischen Anwendungen als auch in der Forschung eine dominante Position einnehmen. Natürlich haben auch Festoxid-Brennstoffzellen und Schmelzkarbonat-Brennstoffzellen einen bestimmten Forschungsstatus. Als nächstes werden wir einige häufig erforschte Brennstoffzellentypen kurz vorstellen.
Protonenaustauschmembran-Brennstoffzelle (PEMFC)
Als eines der Schlüsselm aterialien in Brennstoffzellen haben Protonenaustauschmembranen weltweit breite Aufmerksamkeit und eingehende Forschung von Wissenschaftlern erhalten. Fluorpolymer, aromatisches Polymer und organisch/anorganische Hybridmaterialien wurden nacheinander als Protonenaustauschmembranen entwickelt.
In Protonenaustauschmembran-Brennstoffzellen ist der Elektrolyt eines der Schlüsselm aterialien. Es ist eine sehr dünne Polymermembran, wobei DuPonts Nafion-Perfluorsulfonsäure-Protonenaustauschmembran ein Typ ist. Diese Polymermembran kann Protonen leiten, bleibt jedoch elektrisch nicht leitend. Elektrodenmaterialien bestehen im Allgemeinen aus Kohlenstoff oder Metall, wobei kohlenstoffunterstütztes Platin als Katalysator für die Anoden- und Kathodenreaktionen verwendet wird. Die Betriebstemperatur von PEMFCs beträgt etwa 80°C, und eine einzelne Zelle kann etwa 0,7V Spannung erzeugen. In praktischen Anwendungen müssen zur Erreichung höherer Spannungen mehrere Einzelzellen in Serie geschaltet werden, um einen Brennstoffzellenstapel zu bilden, der typischerweise aus etwa 200-500 Zellen besteht, wobei die genaue Anzahl je nach tatsächlichen Bedingungen und Bedürfnissen angepasst wird.
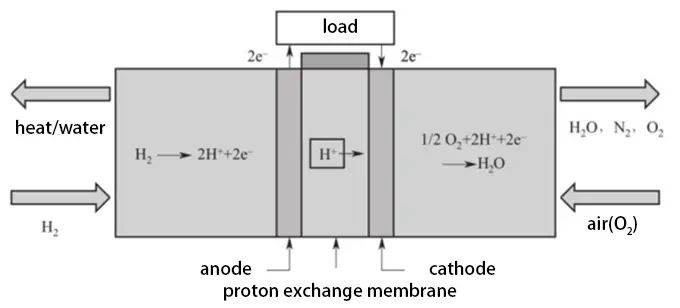
Protonenaustauschmembran-Brennstoffzellen können unter Treibhausbedingungen schnell starten, Wassernebenprodukte leicht abgeben, haben eine lange Lebensdauer, hohe spezifische Leistung, hohe spezifische Energie, kleines Volumen und werden derzeit weit verbreitet in Elektrofahrzeugen und häuslichen verteilten Stromerzeugungsgeräten eingesetzt. Neben diesen Eigenschaften haben sie auch einen hohen Wirkungsgrad, der allgemein 40% bis 60% erreicht, und eine hervorragende dynamische Reaktion, die eine schnelle Anpassung der Ausgangsleistung an den Strombedarf ermöglicht.
Hinweis: Das Leistungsprinzip von Wasserstoff-Brennstoffzellenfahrzeugen
Trotz der offensichtlichen Vorteile von Protonenaustauschmembran-Brennstoffzellen haben sie auch Nachteile. Sie erfordern sehr reinen Wasserstoff und Luftqualität, da der Edelmetall-Platin-Katalysator sehr anfällig für Verunreinigungen durch Kohlenmonoxid und Sulfide ist, die die katalytische Aktivität erheblich verringern und die Lebensdauer der Brennstoffzelle stark verkürzen können.
Alkalische Brennstoffzelle (AFC)
Alkalische Brennstoffzellen (AFCs) entstanden in den 1960er Jahren bei der amerikanischen Firma P&W, die die Bacon-Brennstoffzelle verbesserte, um die AFC zu schaffen. Diese Brennstoffzellen wurden später im Apollo-Programm verwendet. AFCs können Wirkungsgrade von bis zu 70% erreichen und ihr Design ist dem der PEMFCs sehr ähnlich, mit dem entscheidenden Unterschied, dass AFCs eine starke alkalische wässrige Lösung als Elektrolyt verwenden, wie Kaliumhydroxid oder Natriumhydroxid. Während der elektrochemischen Reaktion bewegen sich Hydroxidionen von der Elektrolytlösung zur Anode, wo sie mit Wasserstoff in einer Oxidationsreaktion reagieren und Wasser und Elektronen produzieren. Die Elektronen wandern durch einen externen Stromkreis zur Kathode, wo sie mit Sauerstoff und Wasser reagieren, um weitere Hydroxidionen zu produzieren. Das Funktionsprinzip der AFC ist in der folgenden Abbildung dargestellt:
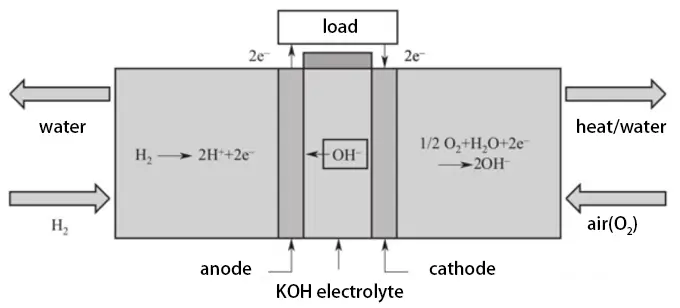
Die Betriebstemperatur von AFCs ist ähnlich wie bei PEMFCs, etwa 80°C. AFCs haben eine schnellere Startgeschwindigkeit, aber ihre Stromdichte beträgt nur etwa ein Zehntel der von PEMFCs, was sie weniger geeignet für tragbare Stromquellen macht. AFCs sind die kostengünstigsten Brennstoffzellen und werden oft in kleinen stationären Stromerzeugungsgeräten verwendet. Die in AFCs verwendeten Katalysatoren können entweder Platin oder nicht-edle Metallkatalysatoren (wie Nickel) sein, was die Kosten für Elektrolyte in AFCs viel niedriger macht als in PEMFCs.
Eine wesentliche Herausforderung für alkalische Brennstoffzellen ist ihre Anfälligkeit für Kohlendioxid. Die Bildung von Karbonaten, selbst aus kleinen Mengen an Kohlendioxid in der Luft, kann die Leistung und Haltbarkeit der Zelle erheblich beeinträchtigen. Obwohl AFCs mit flüssigen Elektrolyten im Umlaufmodus arbeiten können, um den Elektrolyten zu regenerieren und die Auswirkungen der Karbonatbildung zu mildern, führt dieser Modus zu Problemen mit Schleichströmen. Systeme mit flüssigen Elektrolyten haben auch andere Probleme, darunter Benetzbarkeit, erhöhte Korrosion und Schwierigkeiten beim Umgang mit Druckdifferenzen.
Schmelzkarbonat-Brennstoffzelle (MCFC)
Schmelzkarbonat-Brennstoffzellen (MCFCs) sind eine hocheffiziente und nachhaltige Technologie zur Stromerzeugung mit hoher Energieumwandlungseffizienz und sauberen Emissionen, was sie zu einer vielversprechenden Technologie für die Stromerzeugung macht. Aufgrund ihrer hohen Betriebstemperatur und der besonderen Eigenschaften des Schmelzkarbonat-Elektrolyten wurde die Entwicklung von MCFCs jedoch behindert.
Der in MCFCs verwendete Elektrolyt besteht aus Lösungen von Lithiumcarbonat, Natriumcarbonat oder Kaliumcarbonat. Diese Zellen können Wirkungsgrade von bis zu 60 % und eine Betriebsleistung von bis zu 100 MW erreichen. Durch die Nutzung von Abwärme kann der Brennstoffwirkungsgrad zudem bis zu 85 % betragen. Diese hohe Effizienz ist auf die hohen Betriebstemperaturen von 620-660 °C zurückzuführen, die eine flexiblere Nutzung verschiedener Brennstoffarten und kostengünstiger Katalysatoren (wie Nickel) ermöglichen, während gleichzeitig die Leitfähigkeit der Elektrolytlösung sichergestellt wird. Das Arbeitsprinzip der MCFC ist in der untenstehenden Abbildung dargestellt:
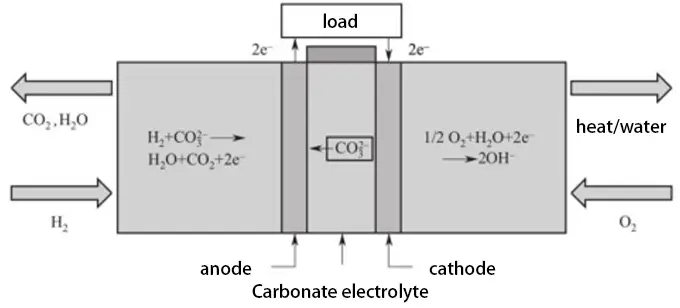
MCFCs können eine Vielzahl von Brennstoffen verwenden, darunter Wasserstoff, Kohlenmonoxid, Methan, Biogas, entschwefeltes Kohlengas oder Erdgas. Die Herstellungsverfahren für MCFC-Membranen und -Elektroden sind ausgereift und ermöglichen die Massenproduktion. Die hohen Betriebstemperaturen und die korrosive Schmelzumgebung können jedoch zu Korrosion und Auflösung der Zellmaterialien führen, was ihre Lebensdauer erheblich verringert. Derzeit ist die Materialkorrosion eine der größten Herausforderungen, die die Entwicklung von MCFCs behindern.
Trotz Problemen wie Stabilität in korrosiven Umgebungen und geringerer Leistungsdichte im Vergleich zu anderen Brennstoffzellen ist die MCFC-Technologie zur bevorzugten Wahl für die kommerzielle stationäre Stromerzeugung geworden. Weltweit testen mehrere Unternehmen Stromerzeugungssysteme im Kilowatt- bis Megawatt-Bereich und bieten MCFC-Systeme für Industrien mit relativ geringem Strombedarf an. Darüber hinaus wird die Anwendung von MCFCs in Bereichen wie dem Seetransport erforscht. Aufgrund der raschen Entwicklung in Forschung und Kommerzialisierung führen MCFCs in der Anzahl der installierten Generatoren unter allen Brennstoffzellentechnologien.
Festoxid-Brennstoffzelle (SOFC)
Festoxid-Brennstoffzellen (SOFCs), auch als keramische Brennstoffzellen bekannt, sind die effizienteste Art von Brennstoffzellen und arbeiten bei hohen Temperaturen von 600-1000°C, was zu einer sehr hohen Reaktionsaktivität führt. Unter allen Brennstoffzellenkonfigurationen haben SOFCs die höchste Energieumwandlungseffizienz. Sie haben auch mehrere Vorteile, wie geräuschlosen Betrieb, geringe Emissionen und eine breite Palette von Brennstoffoptionen (z. B. Erdgas, Synthesegas [eine Mischung aus CO, H2 usw.], Biogas wie Methan, Kohlengas, Kohleflözmethan, Schiefergas und industrielle Nebenproduktgase).
Eine SOFC besteht aus einer Anode, Kathode, Elektrolyt, Interconnect und Dichtungsmaterialien. Die Hauptfunktion der Elektroden besteht darin, eine Stelle für elektrochemische Reaktionen bereitzustellen und die für diese Reaktionen erforderlichen Elektronen zu leiten. Die Hauptfunktion des Elektrolyten besteht darin, Sauerstoffionen oder Protonen zu leiten. Das Interconnect verbindet einzelne Zellen, um eine hohe Leistung zu erzielen, und verhindert direkte Reaktionen zwischen Luft und Brennstoff. Dichtungsmaterialien halten den Brennstoff und die Luft in ihren jeweiligen Strömungsbereichen getrennt.
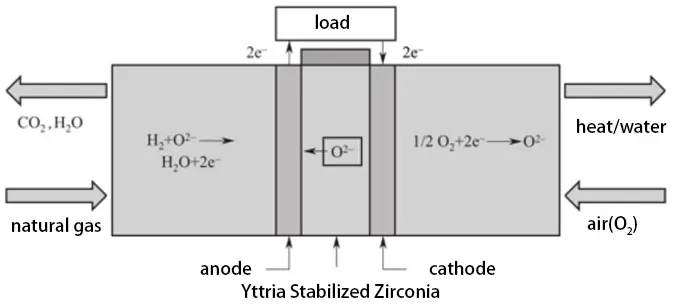
Es gibt zwei Haupttypen von SOFC-Strukturen: Rohrförmig und planar.
Die rohrförmige Struktur ist die früheste entwickelte SOFC-Zellstruktur und stellt derzeit eine relativ ausgereifte Technologie dar. Rohrförmige Zellen haben einen hohen Freiheitsgrad und sind nicht leicht zu brechen; sie verwenden poröse Keramiken als Träger, was die Struktur robust macht; die Zellmontage ist relativ einfach, wodurch es leicht ist, Zellen parallel und in Serie zu kombinieren, um Hochleistungs-Batteriepacks zu bilden. Allerdings haben rohrförmige SOFCs relativ dicke Elektrolyte, was zu einem hohen ohmschen Widerstand und damit zu einer geringeren Leistungsdichte führt.
Die planare SOFC-Struktur und der Herstellungsprozess sind einfacher, was die Herstellungskosten erheblich senken kann. Planare Strukturen verwenden Dünnfilmelektrolyte, die den ohmschen Widerstand der Zelle erheblich reduzieren und ihre elektrochemische Leistung verbessern. Allerdings müssen die Ränder der planaren Zellkomponenten abgedichtet werden, um oxidierende und Brenngase zu isolieren, und die Bipolarplatte-Materialien müssen thermisch mit den Elektrodenmaterialien übereinstimmen und eine gute Hochtemperaturoxidationsbeständigkeit und Leitfähigkeit aufweisen.
Aufgrund der Reaktionstemperatur von SOFCs von 600-1000°C ist die Startzeit relativ lang, was sie für Anwendungen, die ein sofortiges Ein- und Ausschalten erfordern, wie den Transport, ungeeignet macht. Stattdessen sind sie besser geeignet für kohlenstoffarme Stromerzeugungsszenarien, die einen 24-Stunden-Betrieb erfordern, wie Rechenzentren, Fabriken, Häfen, Bürogebäude, Krankenhäuser und abgelegene Inseln.
Direktmethanol-Brennstoffzelle (DMFC)
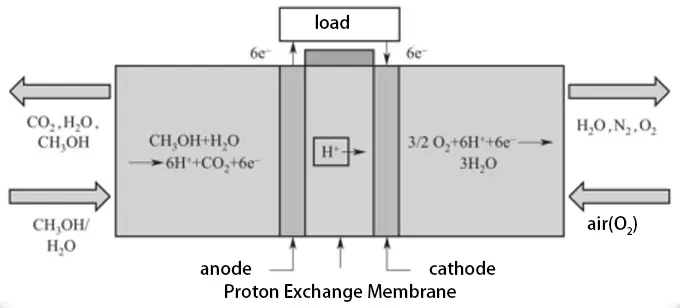
Direktmethanol-Brennstoffzellen (DMFCs) sind eine Art von Protonenaustauschmembran-Brennstoffzellen, die sich durch ihr geringes Gewicht, ihre hohe Leistung, ihre lange Lebensdauer und die Verwendung von Methanol als direkter Brennstoffquelle zur Stromerzeugung auszeichnen. DMFCs verwenden polymere Membranelektroden, ähnlich denen, die in Protonenaustauschmembran-Brennstoffzellen verwendet werden. Während des Betriebs verbraucht die Zelle Wasser an der Anode und produziert Wasser an der Kathode. Bei Verwendung von reinem Methanol ist die Energiedichte der Zelle relativ hoch, was sie zu einer potenziellen Option für Anwendungen in Elektrofahrzeugen macht.
Da DMFCs Methanol direkt als Brennstoff verwenden, sind sie so einfach zu transportieren und zu verwenden wie Benzin. Methanol ist kostengünstig und kann sowohl aus erneuerbaren als auch aus nicht erneuerbaren Ressourcen gewonnen werden. Bekannt als „flüssiges Sonnenlicht“ bietet Methanol Vorteile in Bezug auf die Eigenstromerzeugung und die langfristige Notstromspeicherung. Dies macht DMFCs weit verbreitet in Elektrofahrzeugen, Kommunikationsbasisstationen, militärischen Anwendungen, Schiffsantrieben und verteilten Kraftwerken, mit dem Potenzial, in zukünftigen tragbaren elektronischen Produkten zum Mainstream zu werden.
DMFCs können in zwei Haupttypen unterteilt werden: passiv und aktiv. Sie unterscheiden sich in der Leistungsabgabe und den Komponenten. Passive Brennstoffzellen erzeugen Strom durch den natürlichen Fluss von flüssigem Methanol innerhalb der Zelle, während aktive Brennstoffzellen Pumpen verwenden, um Methanol zur Anode zu zirkulieren. Die Pumpe reguliert die Methanolflussrate und stellt eine konstante Brennstoffzufuhr zur Anode sicher. Ein Steuerungssystem überwacht den Zustand der Brennstoffzelle in Echtzeit und passt die Pumpengeschwindigkeit und Methanolkonzentration an, um eine optimale Leistung aufrechtzuerhalten. Dieser Ansatz ermöglicht es aktiven Brennstoffzellen, eine höhere Leistungsdichte als passive Brennstoffzellen zu erreichen. Die Wahl zwischen den beiden Typen hängt von den spezifischen Anwendungsanforderungen und dem Kompromiss zwischen Leistung und Kosten ab.
Verwandte Artikel:
Detaillierte Erklärung der Struktur und des Prinzips von Proton Austausch Membran-Brennstoffzellen
Die praktische Anwendung von Proton Austausch Membran-Brennstoffzellen

