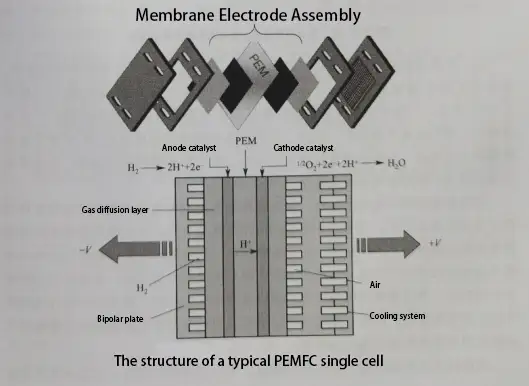
Zusammensetzung und Funktionsweise von Einzelzellen
Eine Protonenaustauschmembran-Brennstoffzelle (PEMFC) ist eine Art von Brennstoffzelle, die eine Protonenaustauschmembran als Elektrolyt verwendet. Die Einzelzelle ist die grundlegende Einheit, die den Brennstoffzellenstapel bildet. Hier sind die Hauptkomponenten und Funktionsprinzipien einer Protonenaustauschmembran-Brennstoffzelle-Einzelzelle:
Komponenten:
Bipolarplatte, Protonenaustauschmembran, Gasdiffusionsschicht, Katalysator
Funktionsprinzip:
Wasserstoffmoleküle zerfallen unter der Wirkung des Anodenkatalysators in Protonen (H⁺) und Elektronen (e⁻). Die Elektronen (e⁻) fließen durch einen externen Stromkreis und erzeugen einen elektrischen Strom, während die Protonen (H⁺) durch die Protonenaustauschmembran von der Anode zur Kathode wandern. An der Kathode verbinden sich Sauerstoffmoleküle mit Protonen und Elektronen und bilden letztendlich Wasser.
Leistungstestmethoden für Einzelzellen
In Protonenaustauschmembran-Brennstoffzellen (PEMFC) gibt es viele Methoden zur Bewertung der Leistung von Katalysatoren, Elektroden, Protonenaustauschmembranen und Bipolarplatten, wie zyklische Voltammetrie (CV), Rotationsscheibenelektrode (RDE), Rotationsring-Scheibenelektrode (RRDE) und elektrochemische Impedanzspektroskopie (EIS). Diese Methoden werden häufig verwendet, um die Leistung von Elektrokatalysatoren und anderen Elektrodenmaterialien zu beurteilen.
Die Leistungsbewertung einzelner Komponenten (wie Katalysatoren oder Protonenaustauschmembranen) kann jedoch nur teilweise Informationen über diese Komponente liefern und nicht direkt die Gesamtleistung der Brennstoffzelle widerspiegeln. Daher ist es notwendig, die oben genannten Komponenten zu einer Einzelzelle zusammenzusetzen und Leistungstests unter festen Bedingungen (wie Temperatur, Druck und Gasdurchflussraten) durchzuführen, um die Auswirkungen dieser Komponenten auf die Gesamtleistung der Zelle zu bestimmen. Im Allgemeinen kann bei Leistungstests der Membran-Elektroden-Einheit (MEA) die Elektrodenfläche auf 0,5~5 cm² reduziert werden. Dieser Größenbereich ist klein genug für effiziente und schnelle Tests, aber groß genug, um die tatsächliche Leistung der MEA zu widerspiegeln.
Elektrochemische Reaktionen und Elektrodenpotenziale
Das innere Funktionieren einer Brennstoffzelle basiert auf den Redoxprozessen elektrochemischer Reaktionen. Das Testen des Reaktionsstroms und des Elektrodenpotentials ist der direkteste und effektivste Weg, um elektrochemische Reaktionen zu charakterisieren. Basierend auf den Standard-Elektrodenpotentialen für Redoxreaktionen weist ein größeres Überspannungspotential auf eine erhöhte zusätzliche Spannung hin, die für die Reaktion erforderlich ist, was normalerweise einen erhöhten Widerstand bedeutet. Für die Zelle zeigt sich eine Erhöhung des Überspannungspotentials als Abnahme der Potentialdifferenz, bekannt als Polarisationsprozess.
Die Größe des Reaktionsstroms spiegelt die Geschwindigkeit wider, mit der die elektrochemische Reaktion abläuft. Im Allgemeinen gilt: Je größer der Strom, desto schneller die Reaktion; jedoch können übermäßig hohe Ströme zur Überhitzung der Elektroden oder zu beschleunigtem Altern führen.
Typischerweise sind die Ausgangscharakteristiken und die Leistung der Zelle von Interesse, und die tatsächlich untersuchten Parameter umfassen die Spannung der Zelle, die Stromdichte und die Leistungsdichte. Die Leistung einer Protonenaustauschmembran-Brennstoffzelle wird normalerweise anhand der Stromdichte-Spannung-Kurve (I-V-Kurve) und der Stromdichte-Leistungsdichte-Kurve (I-P-Kurve) bewertet. Diese Kurven liefern detaillierte Informationen über die Zelle unter verschiedenen Betriebsbedingungen. Beispielsweise zeigt die I-V-Kurve die Betriebsspannung der Zelle bei verschiedenen Stromdichten, während die I-P-Kurve die Leistungsabgabe bei verschiedenen Stromdichten darstellt.
Analyse der Zellleistungsparameter
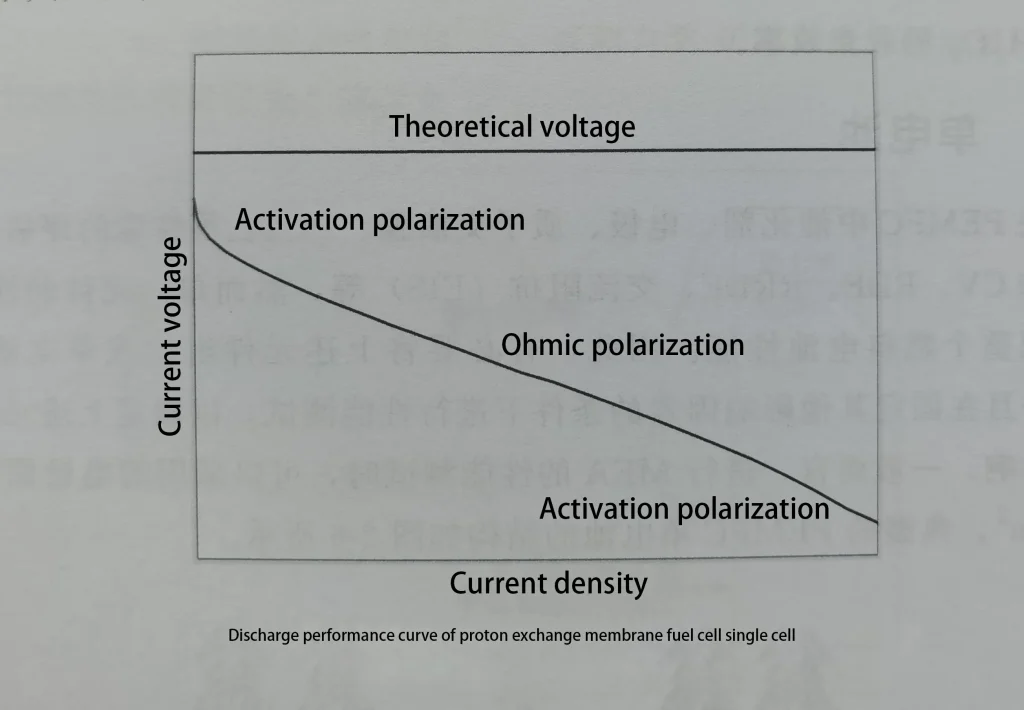
Das theoretische Leerlaufpotential einer Protonenaustauschmembran-Brennstoffzelle (PEMFC) beträgt 1,229V, aber die tatsächliche Leerlaufspannung (OCV) erreicht normalerweise nicht diesen idealen Wert, sondern liegt typischerweise zwischen 0,900V und 1,000V. Diese Diskrepanz ist auf verschiedene Faktoren wie Wasserstoff- oder Sauerstoffdurchtritt, Membranverunreinigung und Elektrodenvergiftung zurückzuführen. Kleine Mengen Wasserstoff oder Sauerstoff können durch die Protonenaustauschmembran zur gegenüberliegenden Elektrode diffundieren, wodurch ein Mischpotential entsteht und die OCV der Zelle verringert wird. Außerdem können Verunreinigungsgase (wie Kohlenmonoxid) eine Elektrodenvergiftung verursachen und die Zellleistung weiter beeinträchtigen.
Durch die Messung der OCV der Zelle kann der Zustand der Protonenaustauschmembran und der Membranelektrode vorläufig bewertet werden. OCV ist jedoch nur ein Indikator für den allgemeinen Zustand der Zelle und muss zusammen mit anderen Einflussfaktoren betrachtet werden. Um die Leistung einer Protonenaustauschmembran-Brennstoffzelle umfassend zu bewerten, müssen auch die drei Hauptspannungsverluste während des Entladevorgangs berücksichtigt werden: Aktivierungspolarisation, ohmsche Polarisation und Massenübertragungspolarisation.
Polarisations phänomen und ihre Auswirkungen
Aktivierungspolarisation: Ursachen und Optimierungsmethoden
Aktivierungspolarisation, auch elektrochemische Polarisation genannt, bezieht sich auf den Spannungsverlust in einer Protonenaustauschmembran-Brennstoffzelle (PEMFC), der durch die Geschwindigkeitsbegrenzungen des Ladungstransferprozesses während der elektrochemischen Reaktionen an den Elektroden verursacht wird. Dieser Polarisationsprozess ist besonders bei niedrigen Stromdichten ausgeprägt. In solchen Fällen sinkt die Zellspannung mit zunehmendem Reaktionsstrom schnell. Zum Beispiel fällt die Spannung von der theoretischen Leerlaufspannung von 1,229V auf etwa 0,8V, obwohl der spezifische Wert je nach System und Bedingungen variieren kann.
Während des Zellbetriebs können verschiedene Methoden die Betriebsbedingungen optimieren, um die Kinetik der Elektrodenreaktionen zu beschleunigen und dadurch das Überspannungspotential der Aktivierungspolarisation zu reduzieren. Diese Methoden umfassen:
Erhöhung der Reaktionstemperatur: Durch Erhöhung der Reaktionstemperatur kann die elektrochemische Reaktionsgeschwindigkeit beschleunigt und somit die Aktivierungspolarisation reduziert werden.
Erhöhung der Reaktantenkonzentration (oder des Drucks): Eine Erhöhung der Versorgungskonzentration der Reaktanten kann die Reaktionsgeschwindigkeit erhöhen und den Spannungsverlust verringern.
Verwendung von Hochleistungselektrokatalysatoren: Effiziente Katalysatoren können die Aktivierungsenergie der Reaktion senken, wodurch die Elektrodenreaktionen schneller und effektiver ablaufen.
Erhöhung der Dreiphasen-Reaktionszone der Membranelektrode: Durch Vergrößerung der Kontaktfläche zwischen Gas-, Flüssig- und Festphasen können die Reaktanten die Katalysatoroberfläche effektiver erreichen und die Reaktionseffizienz verbessern.
Durch den Einsatz dieser Methoden kann das Ausmaß der Aktivierungspolarisation erheblich verbessert und somit die Gesamtleistung der Brennstoffzelle gesteigert werden.
Bei Zelltests kann die Analyse des Aktivierungspolarisationsbereichs der Zellleistungskurve (I-V-Kurve) die Leistung des Katalysators und der Dreiphasen-Reaktionszone der Membranelektrode bewerten. Spannungsänderungen im Bereich niedriger Stromdichten können die Effizienz des Elektrokatalysators und die Qualität des Elektrodenentwurfs widerspiegeln. Eine solche Analyse kann das Design und die Betriebsbedingungen der PEMFC effektiv optimieren und die Leistung und Effizienz der Zelle verbessern.
Der Einfluss der ohmschen Polarisation und Lösungen
Die ohmsche Polarisation bezieht sich auf den Spannungsabfall, der durch den Widerstand während des Ionen- und Elektronentransportprozesses innerhalb einer Batterie verursacht wird, und spiegelt sich hauptsächlich im mittleren Teil der Polarisationskurve der Batterie wider. Unter diesen ist der Membranwiderstand der Hauptbestandteil des ohmschen Widerstands. Nafion-Membranen erfordern ein bestimmtes Maß an Feuchtigkeit, um Protonen richtig zu leiten, und Änderungen der Temperatur und Feuchtigkeit können zu erheblichen Unterschieden in der Protonenleitfähigkeit führen. Bei Nafion-117-Membranen ist die Leitfähigkeit bei hoher Temperatur und hoher Luftfeuchtigkeit (82°C, 100% Luftfeuchtigkeit) 400-mal höher als bei niedriger Temperatur und niedriger Luftfeuchtigkeit (24°C, 10% Luftfeuchtigkeit).
Die Optimierung der Protonenleitfähigkeit von Protonenaustauschmembranen sowie der Leitfähigkeit und des Kontaktwiderstands verschiedener leitfähiger Komponenten innerhalb der Batterie kann dazu beitragen, den ohmschen Polarisationsprozess der Batterie zu verbessern und ihre tatsächliche Leistung zu steigern. In den letzten Jahren wurden viele neue Arten von protonenleitenden Membranen entwickelt, wie z.B. Polymermembranen, die Phosphorsäure (PAE) enthalten, und andere organisch-anorganische Hybridmembranen, die unter bestimmten Bedingungen eine bessere Leistung als Nafion bieten können.
In modernen Protonenaustauschmembran-Brennstoffzellensystemen ist das Feuchtigkeitsmanagement eines der Schlüsselprobleme. Der Einsatz von Technologien wie Gashumidifikatoren oder Membranhumidifikatoren zur Aufrechterhaltung einer angemessenen Membranfeuchtigkeit ist eine wichtige Forschungsrichtung. Gleichzeitig verwenden Hochtemperatur-Brennstoffzellen (HT-PEMFC) phosphorsäuredotierte protonenleitende Membranen, die bei Temperaturen über 100°C betrieben werden können, was dazu beiträgt, Wasser- und Wärmemanagementsysteme zu vereinfachen.
Durch die Anwendung dieser neuen Materialien und Technologien wird erwartet, dass die Leistung und Stabilität von PEMFCs weiter verbessert werden, wodurch ihre breite Anwendung in verschiedenen Bereichen gefördert wird.
Der Einfluss der Massenübertragungspolarisation und Verbesserungsmaßnahmen
Die Massenübertragungspolarisation, auch Konzentrationspolarisation genannt, tritt im späteren Teil der Polarisationskurve der Batterie auf. Die elektrokatalytischen Reaktionen finden innerhalb der Membranelektrode statt, wobei die Reaktanten die Katalysatoroberfläche erreichen müssen, um an den Reaktionen teilzunehmen, und die Produkte müssen von diesem Ort entfernt werden. Wenn die Reaktionsgeschwindigkeit ausreichend hoch ist, kann das produzierte Wasser nicht rechtzeitig abgeführt werden, und die Reaktantengase können die Elektrodenoberfläche nicht reibungslos erreichen, was zu einem schnellen Abfall der Reaktantenkonzentration in der Nähe der Elektrodenoberfläche führt und die Batteriespannung verringert.
Beim Betrieb der Batterie kann die Anpassung der Durchflussrate und des Drucks der Reaktantengase den Prozess der Massenübertragungspolarisation verzögern. Während der Batterietests kann der Konzentrationspolarisationsteil der Batterie-Leistungskurve auch zur Bewertung des Wassermanagements der Batterie verwendet werden. In den letzten Jahren haben Forscher verschiedene fortschrittliche Wassermanagementtechniken entwickelt, wie optimierte Gasströmungskanaldesigns, die Verwendung von hydrophilen/hydrophoben Materialkombinationen und Mikrokanaltechnologie. Diese Techniken verbessern effektiv das Wassermanagement und reduzieren die Auswirkungen der Massenübertragungspolarisation.
Darüber hinaus kann die Verbesserung der Struktur der Katalysatorschicht, wie die Verteilung von Katalysatoren im Nanomaßstab, die Verbesserung der Porenstruktur der Katalysatorschicht und die Optimierung des Designs der Membranelektrodeneinheit (MEA), einschließlich der Katalysatorschicht, der Gasdiffusionsschicht (GDL) und der Bipolarplatten, die Transporteffizienz der Reaktanten erheblich verbessern, die Massenübertragungspolarisation weiter reduzieren und die Gesamtleistung der Batterie verbessern.
Mit der Anwendung dieser neuen Technologien und Optimierungsmethoden wird erwartet, dass die Leistung und Stabilität von PEMFCs weiter verbessert werden, wodurch ihre breite Anwendung in verschiedenen Bereichen gefördert wird.
Verwandte Artikel:
Brennstoffzellen: Leistungstestmethoden für gängige Elektrokatalysatoren
ORR-Reaktionsmechanismus von Protonenaustauschmembran-Brennstoffzellen
Electrode Reactions in Fuel Cells: Anode and Cathode

